W zabiegach regeneracyjnych kość
pochodzenia autogennego (autoprzeszczepy) lub homogennego (banki kości) bywa używana
bardzo chętnie i z dużym sukcesem klinicznym. Aplikacja kości autogennej jest
jednak ograniczona poprzez jej dostępność i dodatkowy stres pacjenta związany
z kolejnym zabiegiem. Zastosowanie kości homogennej wiąże się z ryzykiem immunologicznym,
ryzykiem infekcji takimi chorobami jak AIDS czy żółtaczka.
Na rynku dostępne są również alternatywne syntetyczne substytuty
kostne, takie jak np, hydroksyapatyty, różniące się jednak od tkanki kostnej swą
strukturalną konstrukcją i kompozycją.
Przez lata poszukiwano preparatu całkowicie wolnego od białek,
mogących przenosić choroby. Za najważniejsze uznano możliwie największe podobieństwo
materiału do naturalnej tkanki, warunkujące przyjęcie wszczepu przez organizm.
Wiadomo też było, że niezależnie od wszczepianego materiału musi być on zawsze
przykrywany membraną będącą barierą chroniącą je przed wrastaniem nabłonka.
Opracowanie w 1985roku materiału Bio-Oss stworzyło dostępną
alternatywę zastosowania substytutu posiadającego naturalną, mineralną strukturę
kości zbliżoną do ludzkiej tkanki.
Bio-Oss jest naturalnym materiałem zastępczym pochodzącym z tkanki kostnej. W
trakcie opatentowanego procesu produkcji usuwane są wszystkie składniki mogące
powodować przenoszenie chorób oraz cząsteczki organiczne mogące wywoływać reakcje
alergiczne. Naturalna charakterystyka struktury mineralnej pozostaje mimo to w
dużym stopniu niezmieniona.
Wyjątkowe podobieństwo materiału Bio-Oss do ludzkiej kości autogennej wynika z
naturalnego pochodzenia materiału wyjściowego do jego produkcji.
 Jako surowiec do produkcji Bio-Oss wykorzystuje się kości wołowe.
Wprawdzie kości bydlęce, w przeciwieństwie do tkanki mózgowej, trzewi lub rdzenia
kręgowego, są zaliczane oficjalnie do tkanek wolnych od obecności prionów, to
jednak proces produkcji obejmuje wiele etapów, które w efektywny sposób zniszczyłyby
priony, gdyby w jakiś sposób znalazły się one w materiale. Jako surowiec do produkcji Bio-Oss wykorzystuje się kości wołowe.
Wprawdzie kości bydlęce, w przeciwieństwie do tkanki mózgowej, trzewi lub rdzenia
kręgowego, są zaliczane oficjalnie do tkanek wolnych od obecności prionów, to
jednak proces produkcji obejmuje wiele etapów, które w efektywny sposób zniszczyłyby
priony, gdyby w jakiś sposób znalazły się one w materiale.
Materiał kostny jest podawany, procesowi wygrzewania przez ponad
15 godzin w temperaturze powyżej 300°C, a następnie poddawany kąpieli cztero
godzinnej w silnych zasadach o pH 13, po czym dodatkowo sterylizowany.
W wyniku tych procesów otrzymuje się mineralną strukturę kostną Bio-Oss o wysokim
stopniu oczyszczenia.
Od 1985 roku, kiedy zaczęto powszechnie stosować Bio-Oss dobra
biozgodność materiału była i jest ustawicznie potwierdzana histologicznie. Od
tego czasu ukazało się już drukiem ponad 350 publikacji naukowych na temat Bio-Oss,
a w pracach badawczych uczestniczy nieprzerwanie ponad 90 uczelni na całym świecie.
Materiał Bio-Oss został użyty już u ponad 800.000 pacjentów.
Bio-Oss jest integrowany u pacjenta w procesie naturalnej
regeneracji kości.
Na im dokonuje się budowa i tworzenie nowej, młodej tkanki kostnej. Rozmiar struktury
krystalicznej porów materiału jest czynnikiem determinującym dla integracji wszczepu
z kością pacjenta. Bio-Oss jest naturalnie porowaty i posiada system kanalików
promujących rewitalizację poprzez migrację naczyń krwionośnych i komórek kościotwórczych.
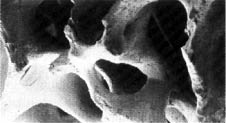  |
50cio krotne powiększenie
w mikroskopie skaningowym drobnoporowatej struktury ludzkiej kości oraz posiadający
taką samą strukturę Bio-Oss (po prawej)
|
Powierzchnia wewnętrzna jest również taka jak w kości gąbczastej ludzkiej czyli
około 80m2 na 1 g preparatu ( mierzone metodą adsorpcji gazowej). Taki
parametr wielkości powierzchni właściwej powoduje ekstremalnie duży kontakt z
komórkami nowo formowanej kości. Jak już wcześniej wspomniano,
niezależnie od wszczepianego materiału musi być on zawsze przykrywany membraną
będącą barierą chroniącą je przed wrastaniem nabłonka. Membrana taka musi być
ustabilizowana.
Dzięki wykorzystaniu odpowiednich błon zaporowych można uzyskać
lepsze gojenie się ran. Ponadto precyzyjne umieszczenie i stabilizacja błony na
pożądanym poziomie powoduje wytworzenie maksymalnej ilości tkanki twardej
Membrana kolagenowa Bio-Gide, którą opracowano razem z Bio-Oss'em
składa się z wysoko oczyszczonych włókien kolagenowych pochodzących z tkanki wieprzowej.
Wspomagają one gojenie tkanki kostnej i błony śluzowej. Zewnętrzna warstwa zbita
chroni kość przed wrastaniem błony śluzowej, a wewnętrzna warstwa porowata sprzyja
integracji nowo powstałej tkanki kostnej.
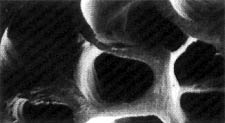
|
Zwarta warstwa górna (komórkowo szczelna)
zapobiega wrastaniu tkanki miękkiej do ubytku, warstwa porowata (dolna) sprzyja
integracji nowo powstającej tkanki kostnej |
Bio-Gide działa jako bariera przez okres od 4 do 6 miesięcy. Dzięki
temu może dojść do niezakłóconej regeneracji kości. Ponieważ błona ulega resorpcji,
nie ma potrzeby przeprowadzania drugiego zabiegu operacyjnego w celu jej usunięcia.
Biomateriały dzięki równoczesnemu użyciu ich z błoną zaporową
służą w chirurgii do:
- odbudowy kości wokół implantów umieszczonych w zębodołach
poekstarakcyjnych
- sterowana regeneracja kości w defektach wyrostka lub odbudowa
wyrostka do implantacji
- podnoszeniu zatoki szczękowej
- rekonstrukcji wyrostka do uzupełnień protetycznych
- wypełnianie ubytków kostnych po resekcjach, wyłuszczaniu torbieli,
ekstrakcjach zębów zatrzymanych itp.
- regeneracji kości w peridontologii, a uścieśniąjąc w naprawie
ubytków kostnych spowodowanych paradontozą i we wzmocnieniu rozchwianych zębów.
Dodatkowo stosuje się często emdogain.
Bio-Oss, jak już wspomniałem, jest naturalnie porowaty i posiada system kanalików
promujących rewitalizację poprzez migrację naczyń krwionośnych i komórek kościotwórczych.
Jednak coraz częściej medycyna sięga po technologie, które mogą stymulować i
wpomóc rozrost tkanek. Głównie chcemy naśladować procesy biologiczne zachodzące
podczas naturalnego rozwoju embrionalnego i wykorzystuje tzw. komórki macierzyste.
 Prasa donosi o wykorzystaniu komórek macierzystych w leczeniu
chorób serca, polegające na stymulacji powstawania naczyń krwionośnych i zastępowaniu
blizn pozawałowych pełnowartościową tkanką mięśniową. Drugą popularną dziedziną
wykorzystującą zdolności komórek macierzystych jest neurochirurgia. Prace te
to w ostatnich latach jedne z większych osiągnięć w medycynie. Prasa donosi o wykorzystaniu komórek macierzystych w leczeniu
chorób serca, polegające na stymulacji powstawania naczyń krwionośnych i zastępowaniu
blizn pozawałowych pełnowartościową tkanką mięśniową. Drugą popularną dziedziną
wykorzystującą zdolności komórek macierzystych jest neurochirurgia. Prace te
to w ostatnich latach jedne z większych osiągnięć w medycynie.
We krwi każdego z nas krążą komórki macierzyste tkankowo specyficzne, które są
zaangażowane w określonych tkankach, np. krwiotwórczej, mięśniowej, mięśnia sercowego,
nerwowej, wątrobowej, kostnej, oraz komórki macierzyste biorące udział w procesach
regeneracji, odnawiania, odtwarzania (np. nabłonek rogówki, nabłonek kanalików
nerkowych).
Istnieją co najmniej dwa rodzaje komórek macierzystych: embrionalne (tzw. prawdziwe
komórki macierzyste) i nieembrionalne (dorosłe lub rzekome komórki macierzyste).
Charakterystyczne cechy komórek macierzystych to :
- klonogenność - oznacza, iż mogą w wyniku podziałów i różnicowania
stworzyć zespół identycznych komórek wchodzących w skład określonej specjalizującej
się lub wyspecjalizowanej tkanki;
- samoodnawialność - zdolność do powielania się w razie potrzeby,
zdolność do różnicowania się poza szpikiem;
- dystrybucja w narządach, pozwalająca na regenerację określonych
tkanek/narządów w określonych warunkach;
- możliwość izolowania - przeszczepianie komórek macierzystych
pochodzących ze szpiku powoduje powstanie tkanki kostnej i szpiku
- plastyczność- komórki macierzyste mają zdolność przekształcania
się we wszystkie rodzaje komórek organizmu.
Ja chciałem zwrócić Państwa uwagę na niembrionalne "dojrzałe" komórki
macierzyste. Mają wprawdzie one ograniczone właściwości w porównaniu z embrionalnymi,
ale mogą być izolowane bez obciążeń etycznych.
Gdzie spotykamy się z komórkami macierzystymi w stomatologii...?
Źródłem komórek macierzystych, łatwych do izolacji jest np.miazga zębów mlecznych.
Już w 6 tygodniu życia płodowego zaczyna kształtować się blaszka zębowa pierwotna
i z biegiem czasu w niej powstają pączki zębowe stanowiące zawiązki zębów mlecznych.
Komórki zębinotwórcze jak i szkliwotwórcze produkujące odmienne, mineralizujące
się tkanki zęba, powstają w wyniku namnażania i różnicowania się populacji prekursorów
rezydujących w miazdze. Obecnych są do końca w miazdze zębów mlecznych.
Stwierdzono, iż miazga zębów stałych jest również źródłem komórek macierzystych
zębinowych, przez to jednak proces regeneracji dotyczy wyłącznie zębiny i polega
na wytworzeniu tkanki zębinopodobnej. Szkliwo jest tkanką nie regenerującą się.
Hodowle komórek macieżystych z miazgi zębów mlecznych to źródło komórek embrionalnych,
ale dających się izolować już po porodzie.
Jak już wspomniałem na początku w krwi krążą komórki macierzyste tkankowo specyficzne
oraz komórki biorące udział w procesach regeneracji, odnawiania, odtwarzania.
Największe bogactwo takich komórek mamy we krwi pępowinowej, ale również możemy
je izolować z krwi dorosłego człowieka.
Inżynieria tkankowa pozwalająca na stymulowanie procesów regeneracyjnych, augmentacyjnych
kości opiera się na teorii, której głównym elementem są komórki mogące pod wpływem
miejscowego środowiska przekształcić się w komórki produkujące brakujące składniki
określonej tkanki.
Coraz bardziej popularna w chirurgii stomatologicznej jest metoda polegająca
na wyodrębnieniu z krwi pacjenta czynników wzrostu, aby stymulować dużo szybszą
odbudowę kości.
Metoda ta wymaga pobrania krwi żylnej w gabinecie stomatologicznym. Następnie
w specjalnej wirówce następuje oddzielenie erytrocytów i leukocytów od osocza
zawierającego płytki, a następnie w drugiej fazie oddzielenie bezkomórkowego
destylatu plazmy od destylatu zawierającego płytki.
Możliwość izolacji masy płytkowej z krwi obwodowej i jej bogactwo w czynniki
kościotwórcze, jest wykorzystywane w stymulowaniu gojenia się ubytków kostnych
w chirurgii stomatologicznej. Jak wykazały badania prowadzone w Zakładzie Chirurgii
Stomatołogicznej ISAM w Warszawie komórki masy płytkowej są aktywniejsze od izolowanych
szpikowych komórek mimo, że w szpiku jest ich więcej.
Masa płytkowa jest dodawana do materiałów używanych w Sterowanej
Regeneracji Kości.
|
